低背景加上高诱导能力使得这种启动子成为细胞因子基因免疫治疗的理想启动子。我们以往的研究表明,高温诱导的癌症基因治疗载体比非调控的基因治疗载体有巨大的优越性(113,125)。当数量相当的病毒载体被注入皮下生长的肿瘤内时,能检测到不同水平的非目的基因的表达。对于报告基因在组成性的细胞巨化病毒启动子控制下的载体,可检测到各种器官和组织基因的表达,如肝、肺、脾(图二).
对于整合有热诱导报告基因的载体(如IL-12),基因表达仅在加热的肿瘤区发现。此外,整合有IL-2基因的热诱导载体被注入瘤内时(剂量为108-109pfu/每鼠),几乎观察不到毒性。这与腺病毒载体有很大不同,腺病毒载体带有控制IL-2基因的组成性启动子,造成相当严重的正常组织毒性,如脾大、昏睡、甚至死亡。尽管瘤内注入同等数量的重组病毒颗粒,仍会产生严重的副作用。因此,用热诱导的方法调节基因表达有显著优势,它可以限制治疗基因的表达只在目标组织,从而降低了不必要的正常组织毒性。最重要的是,尽管热诱导基因的表达是定向而且受限的,病毒的功效仍然相当可观。在黑素瘤B16F10小鼠模型中的应用表明,热诱导的基因治疗在减少肿瘤生长方面有相当强大的杀伤肿瘤作用(图3)。
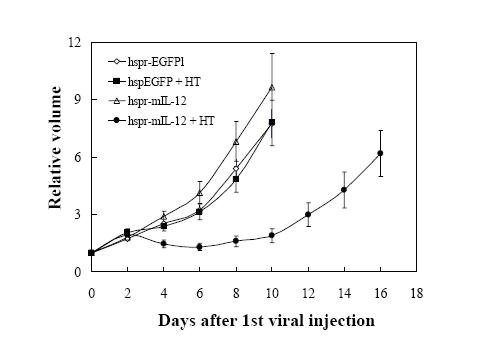
Figure 3. Adenovirus mediated, heat-regulated gene therapy in a mouse melanoma model. Experimental tumors were established in syngeneic C57BL6 black mice by implanting 106 B16F10 melanoma cells. Viral injections were carried out 1 week later when tumors grew to sizes of 5-7 mm in diameter. In the shown experiment, four groups of animals were included. These are mice injected with adenoviruses encoding a) a heat inducible EGFP gene alone (??); b) a heat inducible EGFP gene with heat treatment (à); c) the murine IL-12 gene (??) alone and d) the murine IL-12 gene with heat treatment (à ). There were 10 animals in each group. The error bars for all the data points represent the standard error of the mean (reproduced from reference 27 with permission from AACR).
细胞因子基因治疗与放射或化学治疗的结合对克服实体瘤抗免疫系统的作用是必需的
尽管各种免疫治疗策略有巨大前景,但至今很少取得临床的成功。许多研究人员早就知道,在多数情况下单独的免疫治疗不足以消除肿瘤,因为大多数坚实完善的实体瘤已发展了各种机制下调宿主对肿瘤细胞的免疫反应,这些机制包括:1)实体瘤可能被宿主免疫系统视为免疫隔离部位,从而使它们逃脱免疫监视。
通过"免疫编辑"程序,许多肿瘤细胞对免疫系统基本上是沉默的,很多肿瘤已下调免疫刺激的MHC蛋白或者发生TAP-1基因突变,使他们在免疫监视下拥有隐性的表型 (130,131); 2)肿瘤细胞已建立各种防御武器或障碍,帮助他们对抵免疫系统。例如:某些肿瘤细胞表面表达FAS配体可以杀死T细胞(132,133),免疫抑制性细胞因子IL-10和TGF-β的表达降低免疫效应细胞的活性;3)许多实体瘤发展出了变形的脉管系统,减少粒性白细胞的外渗(134,135),从而避免了免疫系统的激活或共同攻击。
由于众多问题,任何形式的免疫治疗尽管有效,但很难通过自身完全除掉实体瘤尤其是晚期的实体瘤。
幸运的是,免疫治疗有一些补救办法。放射治疗就是一种,它在消灭局部肿瘤生长过程中显示了巨大的潜力。放射疗法与细胞因子免疫治疗的结合即是一个办法,这种方法的原理是:第一,辐射可以"地毯式轰炸"的方式杀死大部分肿瘤细胞,去除肿瘤针对免疫系统的防御性武器;第二,辐射可以诱导更多的免疫刺激基因如MHC-I 、MHC-II 、ICAM-I的表达,有利于免疫效应细胞的外渗和激活(136,137)。第三,辐射诱发的凋亡/坏死可提供丰富的抗原,可能刺激杀伤肿瘤免疫反应(138、139页);第四,刺激免疫系统的综合疗法,可能有助于预防再发性肿瘤在局部成长和肿瘤转移性疾病的根除。
事实上,我们的数据也大大支持了这项综合治疗策略。腺病毒介导的白介素-12(IL-12)基因治疗与放射治疗的结合,与两者单独应用相比,显著增强了抗肿瘤效应(140)(图四)。
化疗与免疫疗法相结合的原理不是那么明显,这是因为化疗优先针对全身的增殖细胞,包括各种免疫效应细胞。因此,一般来说化疗被认为能抑制免疫系统。然而,已经出版的文献报告,化疗与细胞因子基因疗法之间存在协同功效,尤其是较低剂量的应用(141-143)。其确切机制不很清楚。
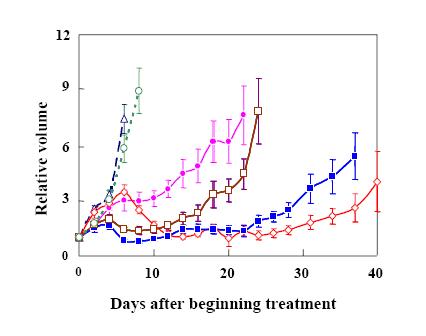
Figure 4. Synergistic anti-tumor efficacy when an adenovirus encoding constitutively expressed IL-12 and B7.1 (AdIL-12/B7.1) was administered after radiation therapy (RAD). (??) untreated control; (??) injection of control AdGFP on day 7 after transplantation (a. Tx.), no radiotherapy (RAD); (??) injection of AdIL-12/B7.1 on day 7 a. Tx., no RAD; (à ) initiation of RAD on day 7 a. Tx., injection of AdGFP after the last (3rd) RAD fraction; (à) initiation of RAD on day 7 a. Tx., injection of AdIL12/B7.1 after the 1st RAD fraction; (??) initiation of RAD on day 7 a. Tx., injection of AdIL12/B7.1 after the last (3rd) RAD fraction. The virus dose injected was 3 × 108 pfu (in 50 μl PBS) except for the injection after the 3rd radiation fraction in 4T1, when 3 × 107 pfu was used. Error bar represents the mean relative tumor volumes (± standard error (SE)) for different combinations of radiotherapy and adenovirus gene therapy in B16.F10 tumors in C57BL/6 mice. See reference 140 for details.
展望
细胞因子免疫基因疗法进入了一个令人振奋的阶段,许多临床前期以及临床研究显示暗示出它的巨大潜力。在不久的将来它很可能会成为治疗癌症的常规方法,不过显然需要继续研究,以优化施药方式和明确用药的情况。相信大多数细胞因子基因疗法将提供辅助治疗(结合外科、化疗、放射治疗),主要目的是消除和防止癌症复发和转移。
| 
