细胞因子的发现预示着免疫学和癌症免疫治疗新时代的到来
细胞因子是一个细胞间信号转导多肽家族,由160多名成员组成。许多的细胞因子如白介素,具有调节癌症免疫应答功能,因此被深入研究以治疗癌症。1976年发现白细胞介素-2(18)标志着癌症细胞因子免疫治疗的开始。二十世纪八十年代纯化的足够数量的IL-2基因使细胞因子在癌症治疗中的应用获得了发展动力。更令人兴奋的是人们认识到IL-2是一种T细胞及自然杀伤细胞(NK)的生长因子及活化剂,而这两种细胞在机体对抗肿瘤细胞中有重要作用。最初的努力大多集中在使用细胞因子扩增所谓的淋巴因子激活的杀伤细胞(LAK)上(29、58),它们主要是被诱导处于极度活化状态的NK细胞。注入LAK细胞具有很大的感染性,尽管对小鼠肿瘤有疗效(59、60)。 然而,这正是所谓的过继免疫治疗的开始,此法通常要注射同源的或同种异体的体内激活的免疫效应细胞以根除肿瘤,其优点是可以获取大量的体外扩增的免疫效应细胞。这种方法后来的模型就是输注体外扩增的肿瘤浸润淋巴细胞(TILS)(34、36)。在黑色素瘤和肾细胞癌患者中使用TILS导致显著的早期反应,然而,随机临床试验效果并不优于IL-2的单独应用 (61)。TILs和LAKs都是美国国立癌症研究所Steven Rosenberg和他的同事提倡的。
除了过继免疫疗法外,IL-2的到来激发了人们把它作为药理学试剂直接用于病人治疗的广泛兴趣,此法即被称为自动免疫治疗。最初的努力主要集中在全身性地注入IL-2激发体内广泛的对抗癌细胞的免疫。此法是基于鼠类动物肿瘤模型实验,该实验中直接注入IL-2有明显的抗肿瘤效应(62-65)。目前,IL-2在美国、加拿大和欧盟已经被批准用于临床上肾细胞癌的治疗,这是根据小规模临床试验反应率统计(1966年至1970年)而批准的。系统性毒性问题已严重限制了许多细胞因子在人类中的广泛应用。尽管发现IL-2带来了初期的研究热情以及很多临床前的数据都暗示了它潜在的抗肿瘤功效,但是明显的临床效果只见于有限的几例肾细胞癌和恶性黑色素瘤患者。除了缺乏功效外,另一个限制IL-2应用的主要因素是全身性的毒性问题,这些毒性包括低血压、血管渗漏、呼吸功能不全 (71、72), 不太严重但限制应用的副作用包括恶心、呕吐、腹泻、肌痛、关节痛、皮肤红斑、瘙痒症。此外不常见的毒性包括心肌梗死、心肌炎、感染、肾衰竭、肠胃梗塞、死亡。肿瘤坏死因子α (TNF-α)是另一个用于全身性抗癌治疗的细胞因子。它在70年代初因其具有强大的杀灭鼠类肿瘤活性而被确定(73),在80年代(74、75)被克隆出来,自此以后进行了多项真对各种人类肿瘤功效的一期和二期临床试验(76-78)。肿瘤坏死因子α至少通过三种机制以消除肿瘤(79):首先,它对肿瘤细胞有直接的溶细胞活性;第二,它可以选择性破坏肿瘤新血管系统导致肿瘤组织出血坏死从而杀死肿瘤(80、81);第三,可以促进T细胞介导的肿瘤细胞免疫能力。因此,它具有强大的杀伤肿瘤活性甚至是对于TNF-α直接毒性不敏感的肿瘤。
大多数临床实验都由于TNF-α带来的严重的全身性毒性而告失败。由于副作用,如低血压、血管渗漏、发热和神经毒性,多数情况下都不能达到有效的抗肿瘤剂量(82)。 事实上,人类只能忍受2%/公斤的剂量,此剂量对抑制小鼠肿瘤是必须的(82,83)。然而,如果能集中到身体特定器官或器室并且达到有效的浓度,肯定能杀灭人类肿瘤(84,85),利用肢体灌注TNF-α治疗骨肉瘤和转移性黑素瘤就是一个很好的例子(86)。
上述两个例子表明,基于细胞因子的免疫疗法是成功的,但其毒性/副作用必须得到解决。
除了毒性的副作用外,全身性注射细胞因子抗肿瘤疗法还有其固有的问题。这些问题是多方面的:有问题的系统注入新的激素治疗癌症的方法. 这些问题是多方面的:1)往往导致人为的高浓度的细胞因子,比系统水平高几个数量级,因此在大多数情况下,造成不必要的副作用,如前一节提到的毒性甚至致死问题;2)虽然全身性的细胞因子浓度,是机体正常情况的数量级倍,但在免疫系统需要激活的部位如肿瘤组织,细胞因子浓度远低于所需;3)大剂量注射细胞因子通常只引起浓度的短时的升高,然后迅速被机体的肝脏或肾脏清除。
因此,没有足够的时间来调动免疫系统对抗肿瘤细胞。要想用细胞因子激活免疫系统对抗肿瘤细胞,就必须重新认识机体自身的免疫系统是如何被激活来抵抗像细菌或病毒这样的外来抗原的。通常这些抗原进入人体各个特定部位,免疫系统通过其各种成分如巨噬细胞、树突状细胞、NK细胞等识别这些抗原,产生局部的危险信号,然后高浓度的细胞因子提供旁分泌信号使各种免疫效应细胞向该部位聚集。局部细胞因子水平升高和免疫效应细胞聚集形成放大回路,,有利于清除入侵之敌,并在许多情况下产生记忆T细胞,当具有相同抗原的有机体再次侵入机体时,免疫系统可以展开迅速而有效的攻击。
从人体自身的免疫系统如何对入侵的外来有机体发起攻击,我们可以得到重要启示:局部的持续高浓度的细胞因子是激活免疫系统所需的。全身性注射,甚至是对宿主有致命毒性的浓度,也很难获得局部所需的高浓度细胞因子。
基因治疗方法大大改善了癌症细胞因子免疫疗法的应用前景
基因疗法出现于90年代早期,为细胞因子注入机体治疗肿瘤开辟了新的方法和机会。各种基因疗法的关键特点是利用基因治疗"载体"将治疗性基因转入局部(87-89)。这些载体包括病毒载体和通过重组DNA技术设计的非病毒载体,它们可以通过局部注射将基因运送到病灶,通常是肿瘤生长的地方(90)。肿瘤基因治疗的原理是这些地方会产生局部的细胞毒性(由于细胞毒性基因)或激发对肿瘤细胞的免疫。
使用局部基因注入的方法产生免疫刺激细胞因子的直接优点是:1)能够产生局部高浓度细胞因子,类似于人体自身对抗外来抗原的反应;2)能够以旁分泌效应方式提供持续高水平的细胞因子来激活免疫系统。
很多不同的基因治疗载体已被用于肿瘤的细胞因子治疗。种类繁多的病毒及非病毒载体已用于基因治疗的实验,其中有用于鼠类的反转录病毒载体,人类和猫的慢病毒载体、腺病毒载体、腺伴随病毒载体、单纯疱疹病毒载体、痘苗病毒载体、鸡痘病毒、塞姆利基森林病毒、裸质粒DNA病毒载体和用基因枪融合的质粒DNA载体。
由于每种载体都有其优缺点,目前对癌症基因疗法的最理想载体还没有达成共识。然而,在上述载体中,鼠类反转录病毒载体、腺病毒载体、疱疹病毒载体、质粒DNA病毒载体是最常用于试验研究的载体,因为它们比较容易操作和制备。他们亦是首批被评估用于人类临床治疗的载体。
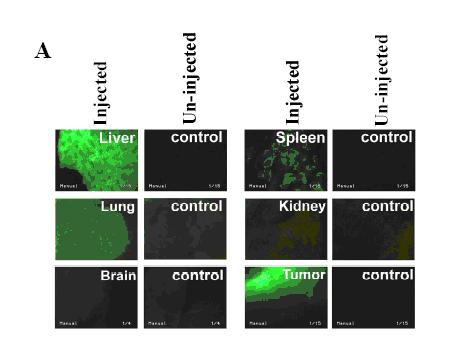
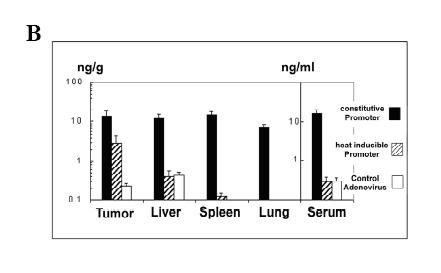
Figure 1. (A) Systemic dissemination of adenovirus after intratumoral injection. About 3 × 108 pfu (plaque forming units) AdGFP/tumor was injected into the center of tumors through syringes with 30-gauge needles. Twenty-four hours later, the tumors and organs of injected mice were harvested, cut, and mounted in aqueous solution for fluorescence microscopy. Expression of green fluorescence protein (GFP) in tumors and organs of tumor bearing C57BL/6 mice after intratumoral injection of adenovirus constitutively encoding GFP (AdGFP) as compared to non-injected control animals (magnification 20 ×). (B) Intratumoral and systemic expression of murine interleukin 12 (mIL-12) after intratumoral vector injection. About 1 × 108 pfu of AdmIL-12 was injected into the center of tumors. Intratumoral and systemic expression of murine interleukin 12 (mIL-12) after intratumoral injection of either control adenovirus (AdGFP used as control in this experiment), adenovirus constitutively expressing mIL-12 (AdCMVIL-12) or adenovirus expressing mIL-12 controlled by a heat inducible promoter (AdhspIL-12) combined with heat treatment in subcutaneous B16.F10 melanomas. Animals were sacrificed 24 hours after heating. The results are plotted as mean ± range of two to four animals per data point (reproduced from reference 124 with permission from AACR).
许多细胞因子基因由于其抗肿瘤效应被评估用于临床前和临床的试验,一些比较常见的包括IL-2, IFN-α, β, γ, IL-12, IL-15, GM-CSF and TNF-α。
基因导入方式主要有两种方式:1)直接注射基因治疗载体到肿瘤组织和其边缘(106);2)把在体外细胞因子基因修改过的自体的或异源的成纤维细胞、干细胞或其他类型正常细胞植入肿瘤组织或边缘区(106)。
| 
